Hur batterier fungerar och fungerar
 I ordets vidaste bemärkelse inom teknik avser termen "batteri" en anordning som tillåter att under vissa driftsförhållanden ackumulera en viss typ av energi, och i andra att använda den för mänskliga behov.
I ordets vidaste bemärkelse inom teknik avser termen "batteri" en anordning som tillåter att under vissa driftsförhållanden ackumulera en viss typ av energi, och i andra att använda den för mänskliga behov.
De används där det är nödvändigt att samla energi under en viss tid och sedan använda den för att utföra stora arbetsintensiva processer. Till exempel tillåter hydrauliska ackumulatorer som används i slussar fartyg att stiga till en ny nivå på flodbädden.
Elektriska batterier arbetar med elektricitet enligt samma princip: först ackumulerar (ackumulerar) de elektricitet från en extern laddningskälla och ger den sedan till anslutna konsumenter att utföra arbete. Till sin natur tillhör de kemiska strömkällor som kan utföra periodiska cykler av urladdning och laddning upprepade gånger.
Under drift sker ständigt kemiska reaktioner mellan komponenterna i elektrodplattorna med deras fyllnadsämne - elektrolyt.
Ett schematiskt diagram av en batterianordning kan representeras av en förenklad ritning när två plattor av olika metaller med ledningar sätts in i kärlets kropp för att tillhandahålla elektriska kontakter. En elektrolyt hälls mellan plattorna.
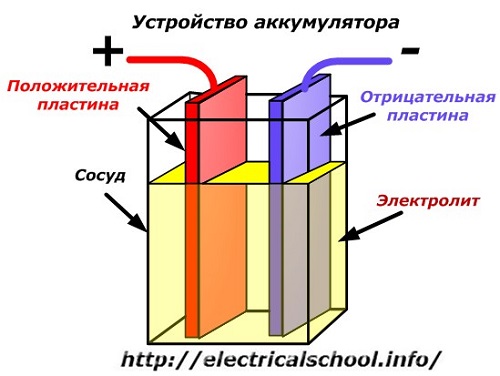
Batteridrift när den är urladdad
När en last, såsom en glödlampa, kopplas till elektroderna skapas en sluten elektrisk krets genom vilken urladdningsströmmen flyter. Det bildas genom rörelse av elektroner i metalldelar och anjoner med katjoner i elektrolyten.
Denna process visas konventionellt på ett diagram med en nickel-kadmiumelektroddesign.
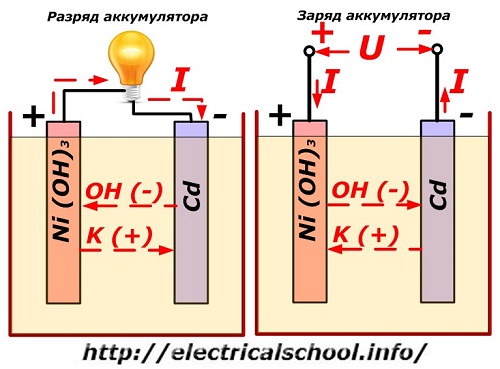
Här används nickeloxider med grafittillsatser, som ökar den elektriska ledningsförmågan, som material för den positiva elektroden. Metallen i den negativa elektroden är svampig kadmium.
Under urladdning släpps aktiva syrepartiklar från nickeloxider ut i elektrolyten och leds till de negativa plattorna, där kadmiumet oxideras.
Batteriprestanda vid laddning
När lasten är avstängd appliceras en konstant (i vissa situationer, pulserande) spänning på plattans terminaler med ett högre värde än det för ett laddat batteri med samma polaritet, när plus- och minuspolerna för källan och konsumenten sammanfaller .
Laddaren har alltid mer kraft, vilket "undertrycker" restenergin i batteriet och skapar en elektrisk ström i motsatt urladdningsriktning. Som ett resultat förändras de inre kemiska processerna mellan elektroderna och elektrolyten. Till exempel, på en låda med nickel-kadmiumplattor, är den positiva elektroden berikad med syre, och den negativa - till ett tillstånd av rent kadmium.
När batteriet är urladdat och laddat förändras den kemiska sammansättningen av materialet i plattorna (elektroderna), men elektrolyten förändras inte.
Batterianslutningsmetoder
Parallellkoppling
Mängden urladdningsström en person tål beror på många faktorer, men främst design, material som används och deras dimensioner. Ju större yta av plattorna vid elektroderna, desto större ström kan de motstå.
Denna princip används för att parallellkoppla celler av samma typ i batterier när det är nödvändigt att öka strömmen till lasten.Men för att ladda en sådan design kommer det att vara nödvändigt att öka kraften hos källan. Denna metod används sällan för färdiga strukturer, eftersom det nu är mycket lättare att omedelbart köpa det nödvändiga batteriet. Men tillverkare av syrabatterier använder det och kopplar ihop olika plattor till enstaka block.
Seriell anslutning
Beroende på material som används kan en spänning på 1,2 / 1,5 eller 2,0 volt genereras mellan de två elektrodplattorna på batterier som är vanliga i vardagen. (Faktiskt är det här intervallet mycket bredare.) Uppenbarligen är det inte tillräckligt för många elektriska apparater. Därför kopplas batterier av samma typ i serie, och det görs ofta i ett fall.
Ett exempel på en sådan design är den utbredda fordonsutvecklingen baserad på svavelsyra och blyelektrodplattor.
Vanligtvis, bland människor, särskilt bland transportförare, är det vanligt att kalla vilken enhet som helst för ett batteri, oavsett antalet beståndsdelar - lådor. Detta är dock inte helt korrekt.Strukturen, sammansatt av flera lådor kopplade i serie, är redan ett batteri, för vilket det förkortade namnet «АКБ» är fäst... Dess inre struktur visas i figuren.
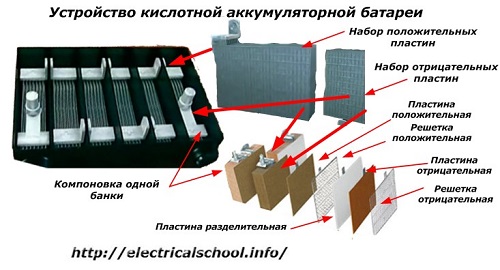
Var och en av burkarna består av två block med en uppsättning plattor för de positiva och negativa elektroderna. Blocken passar in i varandra utan metallkontakt med möjlighet till en pålitlig galvanisk anslutning genom elektrolyten.
I detta fall har kontaktplattorna ett extra galler och är separerade från varandra med en separationsplatta.
Att ansluta plattorna i block ökar deras arbetsområde, minskar det totala motståndet för hela strukturen och låter dig öka kraften hos den anslutna lasten.
På utsidan av lådan har ett sådant batteri de element som visas i figuren nedan.
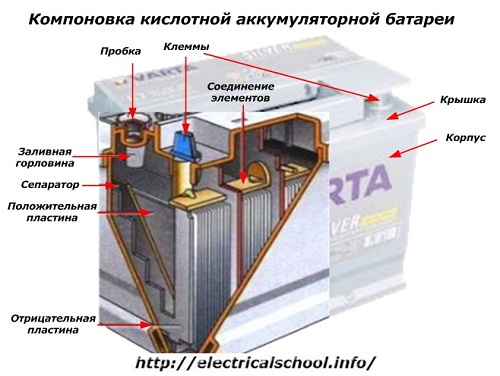
Den visar att det kraftiga plasthuset är förseglat med ett lock och försett med två terminaler (vanligtvis konformade) ovanpå för anslutning till bilens elektriska krets. Polaritetsmarkeringarna är stämplade på deras terminaler: «+» och «-«. Vanligtvis har den positiva terminalen en något större diameter än den negativa terminalen för att blockera ledningsfel.
Användbara batterier har ett påfyllningshål på toppen av varje burk för att kontrollera elektrolytnivån eller tillsätta destillerat vatten under drift. En plugg skruvas in i den, som skyddar de inre håligheterna i höljet från kontaminering och samtidigt förhindrar att elektrolyten spills när batteriet lutar.
Eftersom med en kraftig laddning är gasning från elektrolyten möjlig (och denna process är möjlig under intensiv körning), görs hål i pluggarna för att förhindra att trycket inuti lådan ökar.Syre och väte, såväl som elektrolytångor, kommer ut genom dem. Det rekommenderas att undvika sådana situationer som involverar för höga laddningsströmmar.
Samma figur visar anslutningen av elementen mellan bankerna och arrangemanget av elektrodplattorna.
Bilstartbatterier (blysyra) fungerar enligt principen om dubbelsulfatering. Under urladdning / laddning sker en elektrokemisk process på dem, åtföljd av en förändring i den kemiska sammansättningen av den aktiva massan av elektroderna med frisättning / absorption av vatten i elektrolyten (svavelsyra).
Detta förklarar ökningen av elektrolytens specifika vikt vid laddning och minskningen när batteriet är urladdat. Med andra ord låter densitetsvärdet dig bedöma batteriets elektriska tillstånd. En speciell anordning används för att mäta det - en bilhydrometer.
Destillerat vatten, som är en del av elektrolyten i syrabatterier, förvandlas till ett fast tillstånd - is vid negativa temperaturer. För att förhindra att bilbatterier fryser i kallt väder är det därför nödvändigt att tillämpa särskilda åtgärder som föreskrivs i reglerna för exploatering.
Vilka typer av batterier finns det?
Modern produktion för olika ändamål producerar mer än tre dussin produkter med olika sammansättning av elektroder och elektrolyt. 12 kända modeller körs endast på litium.

Följande kan hittas som elektrodmetall:
-
leda;
-
järn;
-
litium;
-
titan;
-
kobolt;
-
kadmium;
-
nickel;
-
zink;
-
silver;
-
vanadin;
-
aluminium
-
några andra föremål.
De påverkar de elektriska utgångsegenskaperna och därmed applikationen.
Förmågan att motstå kortvariga höga belastningar som härrör från rotationen av vevaxlarna på förbränningsmotorer av elektriska startmotorer är karakteristisk för blybatterier. De används i stor utsträckning inom transport, avbrottsfri strömförsörjning och nödkraftsystem.
Standard galvaniska celler (vanliga batterier) ersätts vanligtvis av nickel-kadmium-, nickel-zink- och nickel-metallhydridbatterier.
Men design av litiumjon eller litiumpolymer fungerar tillförlitligt i mobila enheter och datorer, konstruktionsverktyg och till och med elfordon.
Beroende på vilken typ av elektrolyt som används är batterierna:
-
sur
-
alkalisk.
Det finns en klassificering av batterier efter ändamål. Till exempel, under moderna förhållanden, har enheter dykt upp som används för energiöverföring - laddar andra källor. Det så kallade externa batteriet hjälper ägarna av många mobila enheter i avsaknad av ett alternerande elektriskt nätverk. Den kan upprepade gånger ladda en surfplatta, smartphone, mobiltelefon.
Alla dessa batterier har samma funktionsprincip och en liknande enhet. Till exempel, litiumjonfingermodellen som visas i figuren nedan upprepar på många sätt designen av syrabatterierna som diskuterats tidigare.
Här ser vi samma kontaktelektroder, plattor, separator och hus. Endast de görs med hänsyn till andra arbetsförhållanden.
Grundläggande elektriska egenskaper hos ett batteri
Funktionen av enheten påverkas av parametrarna:
-
kapacitet;
-
energi densitet;
-
självurladdning;
-
temperaturregim.
Kapaciteten kallas batteriets maximala laddning, som det kan ge under urladdningen till lägsta spänning. Det uttrycks i hängen (SI-system) och amperetimmar (icke-systemenhet).
Som en typ av kapacitet finns "energikapacitet", som bestämmer den energi som frigörs under urladdningen till den lägsta tillåtna spänningen. Den mäts i joule (SI) och wattimmar (icke-SI-enheter).
Energitäthet uttryckt som förhållandet mellan mängden energi och batteriets vikt eller volym.
Självurladdning överväg förlusten av kapacitet efter laddning i frånvaro av belastning på terminalerna. Detta beror på designen och förvärras av isolationsbrott mellan elektroderna av många anledningar.
Driftstemperaturen påverkar de elektriska egenskaperna och vid allvarliga avvikelser från den norm som anges av tillverkaren kan det skada batteriet. Värme och kyla är oacceptabla, de påverkar förloppet av kemiska reaktioner och trycket från miljön inuti lådan.
