Polär och opolär dielektrik
Enligt åsikterna från klassisk fysik är dielektrikum fundamentalt annorlunda än ledare, eftersom det under normala förhållanden inte finns några fria elektriska laddningar i dem. Den totala laddningen av de partiklar som bildar dielektriska molekyler är noll. Detta betyder dock inte alls att molekylerna i dessa ämnen inte kan uppvisa elektriska egenskaper.
Alla kända linjära dielektrika kan delas in i två stora grupper: polära dielektrika och opolära dielektrika. Denna uppdelning introduceras på grund av skillnaderna i polarisationsmekanismerna för molekylerna för varje typ av dielektrikum. I själva verket visar sig polariseringsmekanismen vara en extremt viktig aspekt i studiet av både de fysikaliska och kemiska egenskaperna hos dielektrika, och i studiet av deras elektriska egenskaper.
Opolär dielektrik
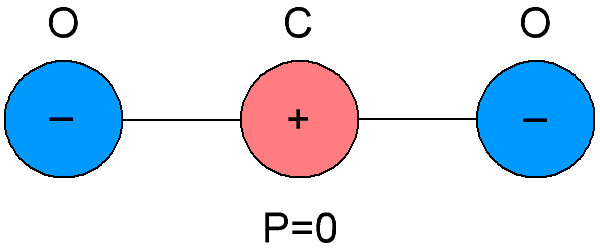
Icke-polära dielektrika kallas också neutrala dielektrika, eftersom molekylerna som dessa dielektrika består av skiljer sig åt i sammanträffandet av tyngdpunkterna för de negativa och positiva laddningarna inuti dem.Som ett resultat visar det sig att molekylerna i opolära dielektrika inte har sitt eget elektriska moment, det är lika med noll. Och i frånvaro av ett externt elektriskt fält är de positiva och negativa laddningarna av molekylerna av sådana ämnen ordnade symmetriskt.
Om ett externt elektriskt fält appliceras på ett opolärt dielektrikum, kommer den positiva och negativa laddningen i molekylerna att förskjutas från sin ursprungliga jämviktsposition, molekylerna kommer att bli dipoler vars elektriska moment nu kommer att vara proportionella mot styrkan hos den elektriska fältet tillämpas på dem, och kommer att riktas parallellt med fältet.
Exempel på opolära dielektrika som framgångsrikt används idag som elektriska isoleringsmaterial är följande: polyeten, polystyren, kolväten, petroleumisolerande oljor, etc. Också ljusa representanter för opolära molekyler är till exempel kväve, koldioxid, metan, etc. Herr.
Opolära dielektrika, på grund av deras låga tangentvärden för dielektriska förluster, används i stor utsträckning som högfrekventa dielektrika i kondensatorer som K78-2.
Polär dielektrik
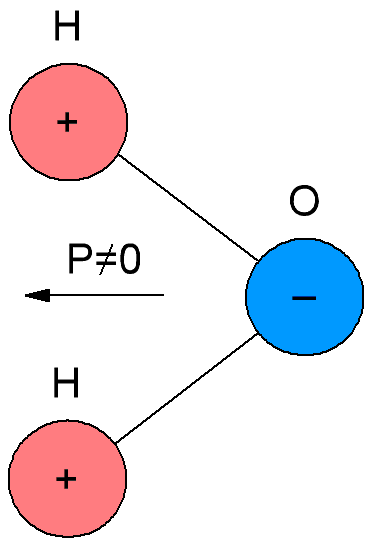
I polär dielektrik, som också kallas dipoldielektrik, har molekylerna ett eget elektriskt moment, det vill säga deras molekyler är polära. Anledningen är att molekylerna av polära dielektrika har en asymmetrisk struktur, så masscentra för negativa och positiva laddningar i molekylerna av sådana dielektrika sammanfaller inte.
Om i en opolär polymer några av väteatomerna ersätts med atomer av andra grundämnen eller av icke-kolväteradikaler, så får vi bara ett polärt (dipol) dielektrikum, eftersom symmetrin kommer att brytas som ett resultat av en sådan ersättning. För att bestämma ett ämnes polaritet genom dess kemiska formel måste forskaren naturligtvis ha en uppfattning om den rumsliga strukturen hos dess molekyler.
När det inte finns något yttre elektriskt fält, är axlarna för de molekylära dipolerna orienterade godtyckligt på grund av termisk rörelse, så att på ytan av dielektrikumet och i varje element av dess volym är den elektriska laddningen i genomsnitt noll. Men när ett dielektrikum introduceras i ett externt fält, uppstår en partiell orientering av molekylära dipoler.Som ett resultat uppstår okompenserade makroskopiskt anslutna laddningar på ytan av dielektrikumet, vilket skapar ett fält riktat mot det externa fältet.
Exempel på polära dielektrika inkluderar följande: klorerade kolväten, epoxi- och fenolformaldehydhartser, kiselkiselföreningar, etc. Vatten- och alkoholmolekyler, till exempel, är också anmärkningsvärda exempel på polära molekyler. Polär dielektrik används i stor utsträckning inom olika teknikområden, såsom piezoelektrisk och ferroelektrisk, optik, olinjär optik, elektronik, akustik, etc.

